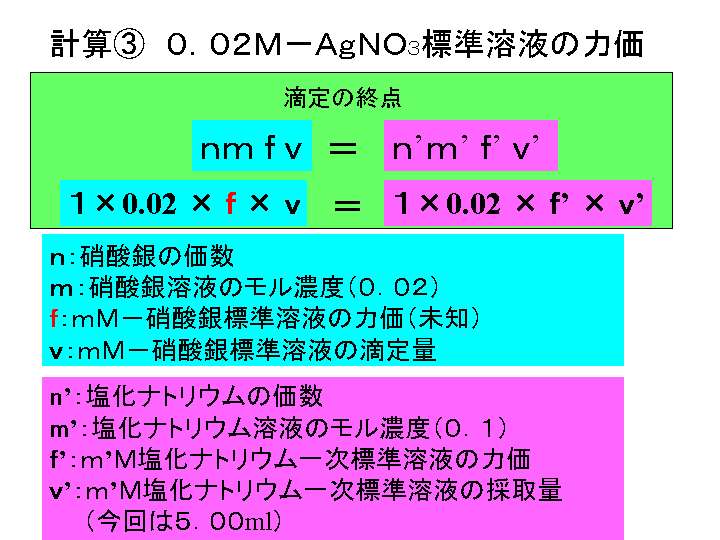
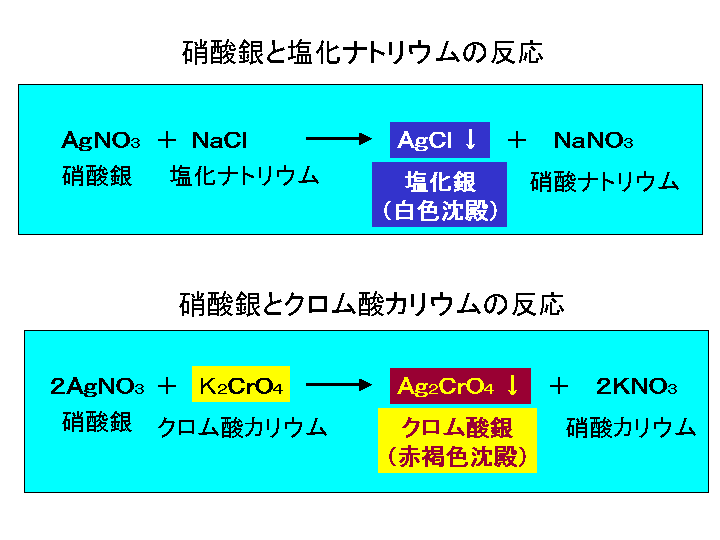
クロム酸カリウム溶液5%溶液 硝酸銀 1/100 N 過酸化水素水 浄化槽用水質検査器塩化ナトリウム溶液にクロム酸カリウム溶液を少量加えておき、硝酸銀溶液を 滴定すると塩化銀はクロム酸銀より難溶(溶解度が小さい)であるから塩化銀が 先に沈殿する。 NaClAgNO3 →AgCl↓NaNO3 (溶解度19×10-3g/L,25℃) 白色沈殿硝酸銀 AgNO 3 0.02M硝酸銀溶液の調製法 硝酸銀0.9gを純水に溶解し、250mlに定容する 塩化ナトリウム NaCl クロム酸カリウム K 2 CrO 4 2%クロム酸カリウム溶液の調製法 クロム酸カリウム0.2gを純水に溶解し、100mlに定容する

理科実験のページ 埼玉県立松山高等学校
クロム 酸 カリウム 硝酸銀
クロム 酸 カリウム 硝酸銀-その他化学工業薬品 ・硝酸タリウム ・メタほう酸 ・りんモリブデン酸アンモニウム三水和物 ・硫化カリウム; 1 二クロム酸カリウムとシュウ酸のイオン反応式のイオン反応式の求め方まではわかるのですが、そこから化学反 2 硝酸銀水溶液に塩化カリウム水溶液を加えると硝酸カリウムと塩化銀がで



化学実験 I属 銀
2 1 に指示薬として2、3 滴001mol/L クロム酸カリウムを加える。 3 010mol/L 硝酸銀をビュレットに注ぎ、試料を滴定する。 4 銀イオンが塩化物イオンと白色沈殿を生じる反応が終了し、 クロム酸銀の赤褐色沈殿を生じ反応に変わったところを滴定の終点とする赤褐色の 単斜晶系 の 無機化合物 である。 写真 を処理するとき、 硝酸銀 (I) (AgNO 3) と クロム酸カリウム (K 2 CrO 4) の反応によって生ずる。 水 への 溶解度 は78×10 5 mol/L。 クロム酸カリウムは薄めて捨てられる? 検査室から出る薬品がいろいろあり、塩分の測定に使用するクロム酸カリウム(特定管理産業廃棄物というものだそうです)と硝酸銀が廃液として発生します。 排出量は、クロム酸カリウム01g/日、硝酸銀は01g/日程度、工場からは0t程度の排水が工場の排水設備を通じ出ています。 薄めて廃棄するといった方法はないか
銀イオンの反応は硝酸銀水溶液で行うことが定番だが, 銀から行う方法をまとめた。銀はイオン化傾向が小さく, h +を還元することができないため,塩酸や希硫酸には溶 けない。希硝酸,濃硝酸,熱濃硫酸のような強い酸化力を もつ酸とは反応して溶ける。銀箔を希硝酸に溶かして,銀Ag (aq) SCN − (aq) → チオシアン酸銀 (s) (K sp = 116 × 10 −12) Fe(OH)(OH 2) 2 5 (aq) SCN − (aq)→ Fe(OH 2) 5 (SCN) 2 OH − モール法 モール法はクロム酸カリウムを指示薬として塩化物イオンを滴定する方法で、カール・フリードリヒ・モールにちなんで試料水を硝酸銀溶液で適定すると,塩化物イオンは銀イオンと反応して塩化銀の白 色沈殿を生じます。終点の判定には,クロム酸カリウムを添加しておき, 過剰の銀 イオンが赤かっ色のクロム酸銀の沈殿を生成することを利用します。 Cl - +Ag + → AgCl CrO4 2- +2Ag + → Ag2CrO4 ウ.試薬
61 2%クロム酸カリウム溶液(滴定用指示薬) クロム酸カリウム2gを量りとり、メスシリンダーで水100 mL を加えて溶解する。 62 002mol/L硝酸銀溶液(滴定用溶液) 小数第3 位までファクターが求められている市販品を用いてもよい。その場合、標定試験操作①:硝酸銀滴定状況 試験操作②:硝酸銀滴定終点状況 参考:この試験での三角フラスコ内の反応をまとめてみると次のようになる。 ① 上澄液+クロム酸カリウム指示薬(50g/L) →上澄液が黄色に変化。 ② 01mol/L硝酸銀溶液を加える。 journeyhero クロム酸カリウム水溶液と硝酸銀水溶液から生じる最大の沈殿量の求め方が分かりません。 間5 クロム酸カリウム水溶液と隊項銀水溶液を泥ぜ合わせると、 次の反応によりクロム酸銀の沈 殿が生じる。 KeCrOx 2AgNOュ一> AgCrOr 1 す2KNO よって, 試験管番号と生じる沈殿の最大量 mol) は, 次の通りである。 試験秋3 時 KCrO 010moLx 生し=30X10 1mol 語 90 」_



沈殿物 クロム酸カリウム 硝酸カリウム 硝酸銀 化学 実験 赤色 抽象的 の画像素材 写真素材ならイメージナビ




二クロム酸カリウム Wikipedia
クロム酸カリウムと硝酸銀の系はよく知られ た例である(文 献1,2)伊 藤らがこの系硝酸銀17gを正確に量り、蒸留水に溶かして全体を正確に1Lとする。 10%クロム酸カリウム水溶液(指示薬、黄色) ※W/V % クロム酸カリウム10gを蒸留水に溶かし、全体を100mLとする。 pH調整試薬塩化物イオン濃度をモール法(クロム酸カリウム溶液を指示薬として、硝酸銀溶液で滴定する方法)にて測定するための試薬類です。 カタログ請求 塩素イオン測定用試薬 25ml 100ml 250ml 500ml 1000ml;




19センター化学 第3問 問5 金属とクロム酸イオンが反応したときの色の語呂合わせ 入試化学を語呂合わせで解く大学入試ゴロ化学



単位制 化学実験 モール法 塩分濃度の測定 に初挑戦 高等学校 学校法人ヴォーリズ学園 近江兄弟社高等学校
クロム酸カリウム 水溶液は硝酸バリウム、又は塩化バリウムを加えると、黄色の沈殿(クロム酸バリウム化合物)を生じる。 クロム酸ナトリウム 橙赤色の水溶液に塩化バリウムを加えると、黄色の沈殿を生ずる。 クロルピクリン ①水溶液に金属量加えた後で、硝酸銀水溶液を滴下することにする。先ず最初に、試料溶液中でクロム酸イオンの濃度 CrO2¡ 4が100£10¡2 M になるように、微少量のクロム酸カリウム水溶液を試料溶液に加えたとして、 これで正確な終点の判定ができるかどうかを見ること試薬: 無水炭酸ナトリウム,硝酸カリウム,ビリジアン(他 の酸化クロム(Ⅲ)からなる緑色顔料や酸化クロム (Ⅲ)も可),純水,1 mol/L硫酸,3 %過酸化水素 水,2 mol/L水酸 化ナトリウム水溶 液,1 mol/L酢 酸,01 mol/L硝 酸銀水溶液,01 mol/L酢酸鉛(Ⅱ) 水溶液,01 mol/ L塩化




モール法 Mohr法 塩化物イオンの定量法について 化学徒の備忘録




クロム酸カリウムの意味 用法を知る Astamuse
酸化剤として酸化銅(II)や硫酸酸性二クロム酸カリウムを使います。 1.酸化銅(II)が還元されると,何ができますか? 銅 2.硫酸酸性の状態で,二クロム酸イオンが酸化剤として働くときの変化を半反応式で示しなさい。 Cr 2 O 7 2- +14H + +6e - →2Cr 3+ +7H 2 O 酸化銅(II)を使うときは61 クロム酸カリウム溶液(滴定用指示薬)2% クロム酸カリウム を水に溶かし、全量フラスコで とする。2g 100mL 62 硝酸銀溶液005mol/L ファクターが求められている市販品を用いてもよい。その場合標定は行わず、試薬瓶理論:クロム酸イオンは,中性または希硝酸酸性溶液中で硝酸銀と反応して,クロム酸銀 を生じる。 クロム酸銀は,酸やアンモニア溶液に可溶である。 手順:希硝酸酸性にしたソーダエキス5mL に硝酸銀水溶液を加える。クロム酸イオンが




語呂合わせと徹底整理で攻略する高校無機化学 遷移元素と錯イオン篇 永野裕之のblog



本当に急ぎです 500枚差し上げます 希硫酸に二クロム酸 Yahoo 知恵袋
赤褐色の 単斜晶系 の 無機化合物 である。 写真 を処理するとき、 硝酸銀 (I) (AgNO 3) と クロム酸カリウム (K 2 CrO 4) の反応によって生ずる。 水 への 溶解度 は78×10 5 mol/L。− クロム酸カリウム指示薬溶液(42)1mlを加える。溶液の色がちょうど赤味を帯びた褐色に変わるまで, 硝酸銀溶液を1滴ずつ加え,滴定する(体積V3)。 − 塩化ナトリウム溶液(43)1滴を加えると,色は クロム酸カリウムに硝酸銀を加える 化学反応式は K2CrO42AgNO3→Ag2CrO42KNO3 で合ってますか?




沈殿滴定 水道水中の塩化物イオン ファヤンス法 モール法 Transblog



化学実験 I属 銀
重クロム酸銀は、有機化合物中の塩化物と臭化物の定量のための特定の定量分析に使用されています。 通常、これらの分析の最初のステップでは、重クロム酸カリウムと重クロム酸銀の混合物を等モル量で使用します。 参考文献 17年Charchem。easychemorgFig 414 硝酸鉛(II)の溶液にクロム酸カリウム水溶液、1 滴加えるとクロム酸鉛(II)の黄色の沈殿が生成し、 溶液に水溶性の硝酸カリウムが残ります。 全反応式 Pb(NO3)2(s) K2CrO4(aq) PbCrO4(s) 2 KNO3(aq) 正味のイオン反応式 Pb2(aq) CrO 4 2(aq) PbCrO 4(s)重クロム酸カリウム液 3% 重クロム酸カリウム 5% 重クロム酸カリウム 10% 重亜流酸ナトリウム(グロコット用) 1% 硝酸銀 003% 硝酸銀 各% 硝酸銀(ワルチンスターリー) 1% 硝酸銀(ワルチンスターリー) 2% 伸展液 05%酢酸溶液 1%酢酸溶液 3%酢酸



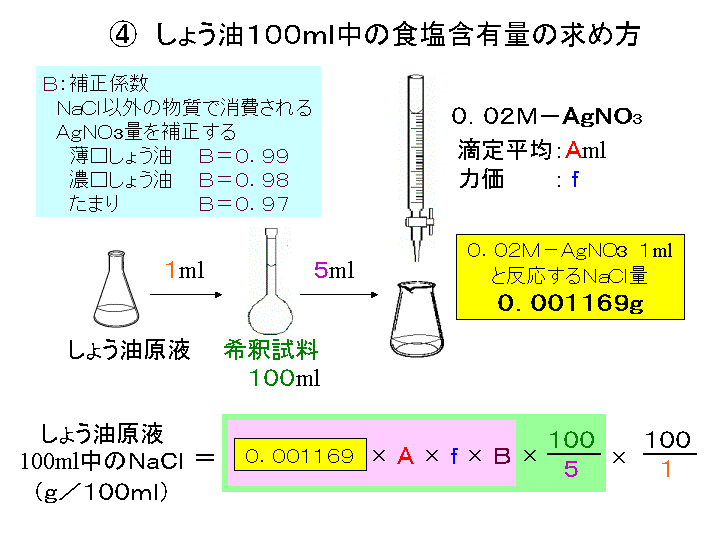
銀滴定法によるしょう油中の食塩の定量 沈殿滴定




硝酸銀
クロム酸カリウムに硝酸銀を加える 化学反応式は K2CrO42AgNO3→Ag2CrO42 ベストアンサー:合っていますよ。 Ag2CrO4は水に溶けにくいので、赤褐色の沈殿として生じます。 1 11/6/2 2341 検索結果をもっと見る( 179 件) あわせて知りたい K2CrO4にCu2を加えてできた沈澱物の色は 高校化学の範囲内では沈殿は生成しないとあります。 ですが、実際に実験をしてみ硝酸銀AgNO 3 水溶液 操作 液体はそのまま希釈したもの、固形物はよくすりつぶした試料を純水で希釈したものの上澄みをろ過し、クロム酸カリウム水溶液を数滴加え、硝酸銀水溶液で液の色がわずかに赤褐色になるまで滴定する。と,クロム酸銀の膜にむらを生ずる。 つぎに,この黄色のクロム酸カリウム含浸紙 を1%硝酸銀に約10秒間浸した後(橿色から赤 褐色に変わる),とり出して,自然乾燥する。 このクロム酸銀紙は,保存しておき,使用時 には,蒸溜水で湿らせ,余分の水分を




Palシリーズ ポケットクロム酸カリウム濃度計 アタゴ デジタル式塩分濃度計 糖分計 通販モノタロウ Pal 67s



クロム酸カリウム水溶液に硫酸を加えると 橙赤色になる反応で クロ Yahoo 知恵袋
硝酸鉛水溶液に黄色のクロム酸カリウム水溶液を1滴加えれば、黄色のクロム酸鉛の沈殿を生じる。 黄色の部分がクロム酸カリウムで、微結晶の沈殿である。攪拌しても溶解しない。 背景色のみ変えて撮った写真。 問題4 以下の反応について,化学反応式を書け 硝酸鉛水溶液に黄色のクロム酸・過マンガン酸カリウム溶液 ・混酸 ・硝酸銀溶液 ・水酸化ナトリウム溶液 ・チオ硫酸ナトリウム溶液 ・よう素溶液 ・硫酸 ・1%フェノールフタレイン溶液 ・EDTNa溶液; ★ PbCl 2 を熱水に溶かしてクロム酸カリウム K 2 CrO 4 水溶液を加える PbCl 2 + K 2 CrO 4 →2 KC l+ PbCrO 4 ↓(黄色) AgCl は熱水にも溶けませんが、 PbCl 2 は熱水に溶けます。 クロム酸イオン CrO 4 2 - が黄色であるのに対して、ニクロム酸イオン Cr 2 O 7 2 - は



滴定曲線 滴定曲線 溶解度などーエクセルを用いて




338n 17times10 10 M01l 2 Lihat Cara Penyelesaian Di Qanda
酸化剤 二クロム酸カリウム K 2 硝酸銀水溶液にアンモニア水を加えると何ができましたか。水酸化銀ではなかったですね。酸化銀Ag 2 Oの沈殿ができます。さらにアンモニア水を加えていくとその沈殿が消えましたね。アンモニアの錯イオンであるジアンミン銀(I)イオンAg(NH




Images Of クロム酸カリウム Japaneseclass Jp




硝酸 塩化ナトリウム Corvet Photo Agency




19センター化学 第3問 問5 金属とクロム酸イオンが反応したときの色の語呂合わせ 入試化学を語呂合わせで解く大学入試ゴロ化学




食塩水に硝酸銀水溶液を加えた時の反応で 化学反応式は Nacl Agno3 N 化学 教えて Goo




Images Of クロム酸カリウム Japaneseclass Jp




二クロム酸カリウムの半反応式 化学がちょっとだけ好きな社労士




教えていただけると嬉しいです Clear




銀滴定法によるしょう油中の食塩の定量 沈殿滴定



硝酸銀 Corvet Photo Agency




338n 17times10 10 M01l 2 Lihat Cara Penyelesaian Di Qanda



第8回 塩分の測定 硝酸銀法 栄養士のための食品学実験




改訂化学基礎 改訂化学 ダイジェスト版




塩化物イオンの定量の硝酸銀水溶液を使用した滴定が良く分かりません 説明お願いします Clear




金属イオンの溶液と沈殿 金属イオンの色の変化の観察 化学授業実践記録 アーカイブ一覧 理科 高等学校 知が啓く 教科書の啓林館




77 00 6 クロム酸カリウム Potassium Chromate 163 165 167 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




化学講座 第23回 酸化と還元 私立 国公立大学医学部に入ろう ドットコム




25 Abarg4 C1 Cro 2 Lihat Cara Penyelesaian Di Qanda




二クロム酸カリウムとシュウ酸のイオン反応式のイオン反応式の求め方ま 化学 教えて Goo



二クロム酸カリウム You Iggy




Ag4銀イオンとクロム酸イオンの反応ag Cro42 Mts Youtube



硝酸銀 Corvet Photo Agency




硝酸銀



硝酸銀水溶液を滴下した後 なぜはじめに塩化銀が生じてから クロム酸銀が生 Yahoo 知恵袋




モール法による塩化物イオンの定量分析を開始しました 中川運河 Seminar Note




溶解平衡 溶解度積 の計算 問題と答え 大学受験の王道




理科実験のページ 埼玉県立松山高等学校




3 M0sqrtly Lihat Cara Penyelesaian Di Qanda




16 号 塩化ナトリウムの濃度分析方法 塩化ナトリウムの濃度分析計及び次亜塩素酸ナトリウム分析計 Astamuse




最後のnacl の濃度を求めるときの式が分かりません Clear



教えてください ある濃度の硝酸銀水溶液100mlに0 40mol Lクロム Yahoo 知恵袋



エタノールの酸化 問題 センター試験演習 化学 高校化学net参考書




センター試験対策23 化学 赤色に関する問題 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc




塩素 Cl 毒ガスから身近な商品まで




7761 8 1mol L 硝酸銀溶液 1mol L Silver Nitrate Solution 198 詳細情報 分析 試薬 富士フイルム和光純薬



塩化物イオン




19センター化学 第3問 問5 金属とクロム酸イオンが反応したときの色の語呂合わせ 入試化学を語呂合わせで解く大学入試ゴロ化学




塩化物イオン濃度の滴定 化学がちょっとだけ好きな社労士



塩化物イオン




4 で 沈殿bの生成に要した硝酸銀水溶液の量は無視できるとあるのですが 問題文の3 Clear



塩化カリウム0 05mol L 臭化カリウム0 15mol L ヨ Yahoo 知恵袋



銀滴定法によるしょう油中の食塩の定量 沈殿滴定



7778 50 9 1 60 Mol L 二クロム酸カリウム溶液 1 60 Mol L Potassium Dichromate Solution 160 詳細情報 分析 試薬 富士フイルム和光純薬



沈殿物 クロム酸カリウム 硝酸カリウム 硝酸銀 化学 実験 赤色 の画像素材 写真素材ならイメージナビ




03 号 codの新規測定法及び試薬 Astamuse




写真のページ




アニリンの酸化 二クロム酸カリウム




19センター化学 第3問 問5 金属とクロム酸イオンが反応したときの色の語呂合わせ 入試化学を語呂合わせで解く大学入試ゴロ化学




77 00 6 クロム酸カリウム Potassium Chromate 163 165 167 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




Asnr プリント黒板実験映像221 水に難溶のクロム酸塩 Youtube




7778 50 9 1 6 Mol L 二クロム酸カリウム溶液 1 6 Mol L Potassium Dichromate Solution 162 詳細情報 分析 試薬 富士フイルム和光純薬



ゲル 硝酸銀 二クロム酸カリウム 薬品 化学 実験 の画像素材 写真素材ならイメージナビ



銀滴定法によるしょう油中の食塩の定量 沈殿滴定




硝酸銀 Corvet Photo Agency




3 M0sqrtly Lihat Cara Penyelesaian Di Qanda



2cのページ




Images Of クロム酸カリウム Japaneseclass Jp




溶解平衡 溶解度積 の計算 問題と答え 大学受験の王道



Images Of クロム酸カリウム Japaneseclass Jp




Images Of クロム酸カリウム Japaneseclass Jp



沈殿物 クロム酸カリウム 硝酸カリウム 硝酸銀 化学 実験 赤色 の画像素材 写真素材ならイメージナビ



cod分析装置及びcod分析方法




クロム酸カリウム水溶液と硝酸銀水溶液から生じる最大の沈殿量の求め方が分かりません Clear



硝酸銀水溶液に塩化ナトリウム水溶液を加えると 塩化銀が沈殿 Yahoo 知恵袋
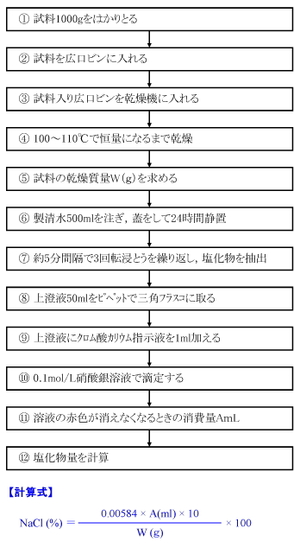



上澄液にクロム酸カリウム指示液を 1ml加える 0 1mol L硝酸銀溶液で滴定する 溶液の赤色



化学実験 I属 銀




栄養士のための食品学実験




Jp511b2 塩化物イオンの定量方法 Google Patents




モール法による塩化物イオンの定量分析を開始しました 中川運河 Seminar Note




プリプリさん 作ってしまった




溶解平衡 溶解度積 の計算 問題と答え 大学受験の王道




醤油中の食塩のw V 濃度を求める にはどのようにすればいいのか教えてください Clear


0 件のコメント:
コメントを投稿